 2020.07.13
2020.07.13  4827次
4827次
轉錄因子(Transcriptionfactor,TF)是一種能與特異DNA序列結合的蛋白,可以單獨或與其他蛋白形成複合體,提高或阻斷特定基因對RNA聚合酶的招募,調控基因的表達。轉錄因子的特點是它包含一個或多個DNA結合域(DNA-binding domain,DBDs),通過這些結合域與基因附近的DNA序列結合,從而完成調控。下面結合文章介紹轉錄因子的研究方法。
01、案例文章簡介
案例文章:
Ahr-Foxp3-RORt axis controls gut homing of CD4+T cells by regulating GPR15. Sci Immunol. 2020, 5(48). (IF=13.44)

GPR15是一種趨化因子受體,在T細胞向大腸歸巢的過程中發揮重要作用。這項研究發現小鼠大腸Treg中的GPR15表達水平最高,芳香烴受體(Ahr)可通過增加GPR15的表達促進Treg向大腸的歸巢,而Foxp3及RORγt在Ahr介導的GPR15表達上調中分别起到正向及負向調控作用。另外,在人結腸Treg中也可重複上述發現。該研究提示,Ahr-Foxp3-RORγt軸可通過調控GPR15的表達調節Treg的腸道歸巢,從而影響腸道免疫穩态。
02、案例文章的研究内容
GPR15在小鼠大腸Treg中表達量最高,并且受Ahr控制。GPR15是一種孤兒鳥嘌呤核苷酸結合蛋白(G蛋白)偶聯趨化劑受體(GPCR),最初是基于其與其它GPCR家族成員的相似性而被發現的,也被稱爲HIV或猿猴免疫缺陷病毒共受體。最近有研究表明,GPR15對小鼠和人的調節性T細胞(Treg)和效應T細胞(Teff)的腸道歸巢至關重要。芳香烴受體(Ahr)是一種環境傳感器,可檢測外源性配體,如環境毒素(如二惡英),以及宿主細胞、微生物群和飲食(如色氨酸代謝物)産生的内源性配體。通過流式細胞術檢測GPR15蛋白在各種T細胞中的表達水平,發現Treg中GPR15的表達水平最高。在Ahr缺陷小鼠的CD4+ T細胞中,GPR15的表達水平降低。而在在Ahr過量表達小鼠的CD4+ T細胞中,GPR15的表達水平升高。

Ahr通過直接與Gpr15基因座結合調節GPR15表達。利用ChIP-seq在iTreg 和TH17細胞中發現Gpr15基因是Ahr最重要的全基因組靶點之一。Ahr在Gpr15基因座具有兩個實質性的結合峰(在距轉錄起始點+15和+17 kb處)。
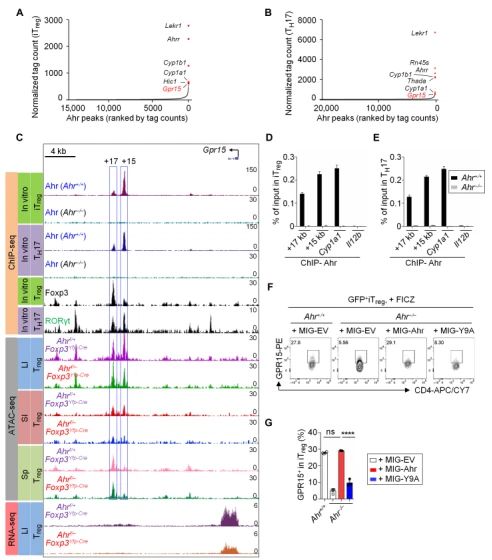
Foxp3與Ahr協同作用,正調節GPR15的表達。在CD4+ T 細胞中用shRNA幹擾Foxp3,GPR15的表達水平降低。在來自Ahr+/+小鼠的iTregs細胞中強制表達Foxp3可顯著提高其GPR15的表達,在來自Ahr-/-(Ahr缺陷)小鼠的iTregs細胞中卻沒有這種效果。在TH0條件下培養的分選CD4+T細胞中同時表達Ahr和WT Foxp3或Foxp3△FKH可以增加GPR15的表達,而Foxp3單獨表達并不影響GPR15的表達。ChIP-qPCR表明Foxp3在Gpr15基因座的結合位點與Ahr相同(距轉錄起始點+15和+17 kb處)。Ahr缺陷不影響Foxp3在Gpr15位點的結合,但是在iTreg中敲低Foxp3後,Ahr向Gpr15基因座的招募減少。

RORγt負向調節GPR15表達。在RORγt缺陷Treg中,GPR15的表達增加。RORγt和GPR15表達的負相關系在Ahr充足和Ahr缺陷Treg中都很明顯。此外,與來自RORγt充足的CD4+ T細胞分化的iTregs和TH17細胞相比,來自RORγt缺陷的CD4+ T細胞具有更高的GPR15表達。

RORγt拮抗Ahr在Gpr15基因座的DNA結合。在從RORγt缺陷小鼠分化的iTregs或TH17細胞中,Gpr15基因座的Ahr募集顯著增強,而在沒有Ahr的情況下,Gpr15基因座的RORγt結合顯著增加,提示Ahr和RORγt與Gpr15基因座結合存在競争。此外在RORγt缺陷iTregs中表達RORγt抑制GPR15表達。

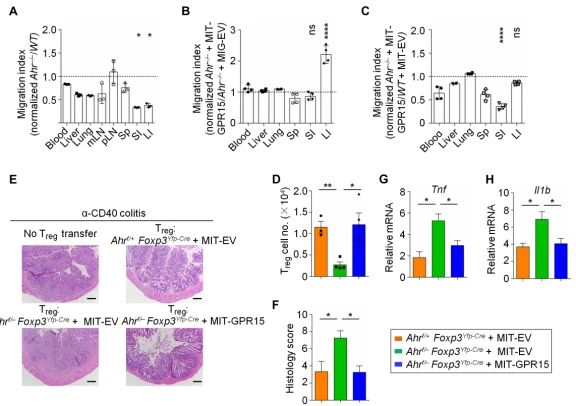
Ahr通過調節GPR15促進Tregs向腸道歸巢。在大腸(LI)和小腸(SI)中,歸巢的Ahr缺陷iTreg相對于WT對照組減少了大約三倍。GPR15的強制表達顯著增強了Ahr缺陷Treg向LI的歸巢,但不增強到包括SI在内的其他器官的歸巢,這與GPR15在Treg大腸歸巢中的關鍵作用一緻。此外, 在LI中WT-iTreg和GPR15恢複表達的Ahr缺陷iTreg的歸巢能力相當(而不是在SI中),這表明GPR15在Ahr缺陷iTregs中的表達受損是其向LI歸巢缺陷主要機制。在Ahr缺陷的iTregs中強制表達GPR15促進其在炎症期間歸巢至LI。此外,強制表達GPR15的Ahr缺陷iTreg的過繼性轉移顯著抑制了腸道炎症,表現爲減輕了腸道組織學變化和降低了促炎細胞因子(即Tnf和Il1b)的表達。
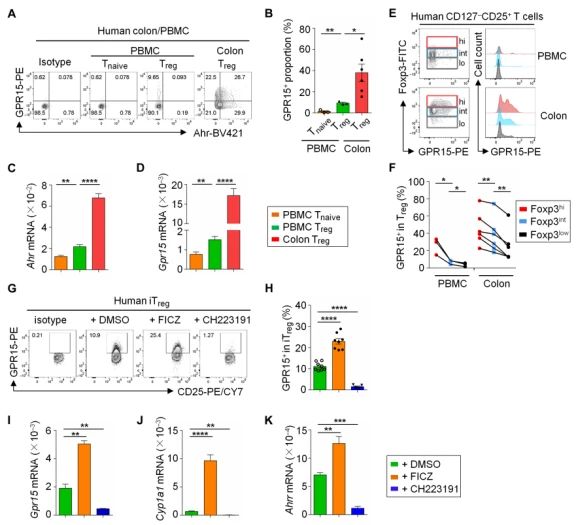
Ahr信号促進GPR15在人Treg中表達。與之前的報告顯示GPR15在人類Treg中的低表達不同,本研究檢測到GPR15在所有患者樣本中的表達。與外周血單個核細胞(PBMCs)相比,結腸Treg的 GPR15表達顯著增高。人Treg中Ahr mRNA表達的增加與Gpr15表達的增加以及其他Ahr靶基因(Cyp1a1和Ahrr)的表達增加有關,這與Ahr促進Gpr15表達的作用相一緻。此外,通過蛋白質染色分析GPR15和Foxp3的表達,發現Foxp3的表達與人CD127-CD25+ T細胞中GPR15的表達呈正相關。加入Ahr的配體FICZ顯著增強了iTreg中GPR15和其他Ahr靶基因的表達,但不增強Ahr的表達,而用一種特異性Ahr拮抗劑CH223191治療可消除人iTregs中GPR15的表達。
03、轉錄因子研究的技術手段
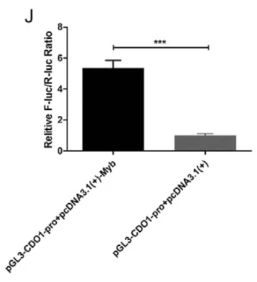
❶ 雙螢光素酶實驗
某些轉錄因子僅與其靶啓動子中的特異序列結合,這些特異性的序列被稱爲順式作用元件,轉錄因子的DNA結合域和順式作用元件實現非共價結合,從而對基因的表達起增強或抑制的作用。雙螢光素酶報告實驗(dual luciferase assay)是檢測轉錄因子和靶啓動子中的特異順序結合的重要手段,通過檢測轉錄因子表達水平的改變對熒光素酶基因表達水平的影響,分析轉錄因子能否作用于啓動子。
其原理簡述如下:
(1)構建一個将靶啓動子的特定片段插入到螢光素酶編碼序列上遊的報告基因質粒,如pGL3-basic等。
(2) 将要檢測的轉錄因子的表達質粒、幹擾質粒或者siRNA與報告基因質粒共轉染293細胞或其它相關的細胞系。通常會用另一種螢光素酶作爲内參,避免轉染效率對實驗結果的影響。
(3) 加入特定的螢光素酶底物,螢光素酶與底物反應,發光,通過檢測發光強度可以測定螢光素酶的活性,從而判斷轉錄因子是否能與靶啓動子片段有作用。
❷ 染色質免疫共沉澱
染色質免疫沉澱技術 (chromatin immunoprecipitation assay,ChIP)被廣泛用于研究體内轉錄因子與靶基因啓動子上特異性核苷酸序列的結合,并已成爲研究染色質水平基因表達調控的最有效的方法。ChIP的基本原理是在活細胞狀态下固定蛋白-DNA複合物,并将其随機切斷爲一定長度的染色質小片段,然後通過免疫學方法沉澱此複合體,特異性地富集目的蛋白結合的 DNA 片段。通過對目的片斷的純化與檢測,從而獲得蛋白質與DNA相互作用的信息。通過qPCR或二代測序,篩選與目的蛋白互作的DNA信息。ChIP-PCR用于鑒定轉錄因子結合到靶基因的啓動子上,而ChIP-seq用于篩選轉錄因子直接結合的靶基因,探究轉錄因子的作用元件。

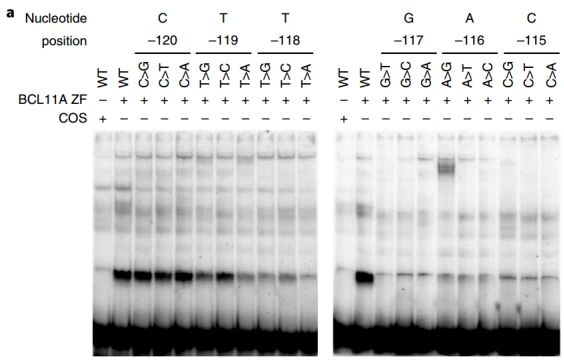
❸ 電泳遷移率改變試驗
電泳遷移率改變試驗 (electrophoretic mobility shift assay,EMSA ) 也稱凝膠阻滞試驗,DNA 在凝膠中的遷移率與相對分子質量及構型有關。裸露DNA與含有結合蛋白的DNA- 蛋白質複合物電泳時,裸露 DNA 遷移率主要取決于DNA本身,DNA-蛋白質複合物由于體積較大而滞留在較後位置。電泳遷移率改變試驗用于體外分析轉錄因子與靶基因啓動子的結合。将一系列序列不同的DNA片段與轉錄因子進行電泳遷移率改變試驗,可以探究轉錄因子的體外結合序列。



 返回列表
返回列表